L’exposition aux maladies propagées par les tiques augmente le risque de développer une MRC (maladie rénale chronique)
Deux études rétrospectives1,2 ont été menées afin de déterminer si l’exposition à une maladie propagée par les tiques s’associait à un risque accru de maladie rénale. Ces études ont mis en lumière un lien entre un résultat positif au dépistage de la maladie de Lyme ou de l’ehrlichiose et un risque accru de maladie rénale chronique (MRC) chez les chiens dans les zones d’endémie. Les chiens qui avaient obtenu un résultat positif au test de dépistage de la maladie de Lyme par la détection d’anticorps ou un résultat positif au test de détection d’anticorps anti-Ehrlichia dans les zones où Ehrlichia canis est endémique présentaient, respectivement, un risque plus élevé de 43 % et de 112 % de développer une MRC (figure 1).
Risque de MRC
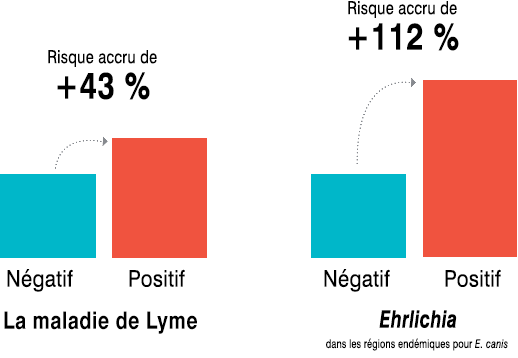
Figure 1. Risque de MRC chez les chiens qui obtiennent un résultat positif au dépistage de la maladie de Lyme ou de l’ehrlichiose dans les zones d’endémie
Introduction
Les contacts avec les tiques sont de plus en plus difficiles à éviter. Ces parasites adaptables sont responsables de la propagation de diverses maladies à travers les États-Unis, et le territoire géographique où des tiques sont présentes s’agrandit. Pour protéger les animaux et les humains, il faut rester à l’affût des risques. Cela signifie que les animaux de compagnie, y compris ceux qui sont asymptomatiques ou qui semblent en bonne santé, doivent être régulièrement testés pour déterminer s’ils ont été exposés à des tiques infectées. N’oubliez pas qu’une seule tique peut transmettre plusieurs agents infectieux causant des maladies graves. L’impact néfaste d’une infection sur la santé d’un animal peut parfois être difficile à déterminer, en particulier chez les animaux asymptomatiques.
La présentation clinique de la maladie de Lyme et de l’ehrlichiose peut varier
Dans le cas de la maladie de Lyme, des études avec infection contrôlée ont montré que seule une fraction des chiens ayant une pathologie de la capsule articulaire présentaient des signes cliniques de polyarthrite3,4. Encore moins de chiens exposés présentaient une atteinte rénale sévère se manifestant par une néphropathie aiguë avec perte de protéines, évolutive et souvent mortelle, classiquement reconnue comme la néphrite de Lyme5. Par conséquent, le fait de s’appuyer uniquement sur les signes cliniques de léthargie ou de boiterie changeant de patte peut ne pas suffire pour faire soupçonner aux médecins vétérinaires une maladie sous-jacente affectant les articulations, les reins ou d’autres organes ou systèmes. De même, dans le cas de l’ehrlichiose, les praticiens se fient parfois à des anomalies hématologiques et biochimiques, telles que la thrombocytopénie et l’hyperglobulinémie, pour indiquer la présence d’une infection active chez un chien séropositif. Cependant, au cours de la phase subclinique de l’ehrlichiose, ces anomalies peuvent être inconstantes ou subtiles6 en raison de mécanismes compensatoires.
Protocole des études
Deux études de cohorte rétrospectives ont été menées chez IDEXX pour déterminer si l’exposition à une maladie transmise par les tiques s’associait à un risque accru de maladie rénale1,2. Dans les deux études, les sujets étaient des chiens résidant aux États-Unis pour lesquels on détenait au moins un résultat de test SNAP 3Dx, SNAP 4Dx ou SNAP 4Dx Plus et au moins un résultat de test IDEXX SDMA et un résultat de créatinine. La densité urinaire a également été notée, mais n’était pas une mesure obligatoire. Les données utilisées pour diagnostiquer une maladie rénale ont été recueillies auprès des Laboratoires de référence IDEXX entre le 13 juillet 2015 et le 17 janvier 2017 pour l’étude sur la maladie de Lyme et entre le 13 juillet 2015 et le 1er janvier 2018 pour l’étude sur l’ehrlichiose. Les données sur les maladies à vecteur de cette même cohorte ont ensuite été obtenues à partir des bases de données des Laboratoires de référence IDEXX et de IDEXX SmartService Solutions afin de déterminer l’exposition des patients aux maladies propagées par les tiques entre le 1er janvier 2003 et le 1er janvier 2017 (maladie de Lyme) et entre le 1er janvier 2003. et le 1er janvier 2018 (Ehrlichia). Les populations de patients ont été limitées en fonction des zones géographiques locales connues pour la transmission de Borrelia burgdorferi, l’agent causal de la maladie de Lyme (figure 2a), et d’Ehrlichia canis, une espèce du genre Ehrlichia (figure 2b).
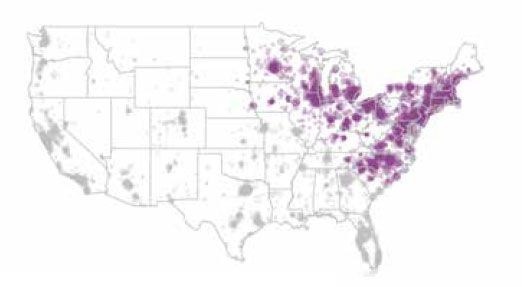
Les points mauves représentent la maladie de Lyme dans les zones d’endémie.
Figure 2a. Maladie de Lyme dans les zones d’endémie
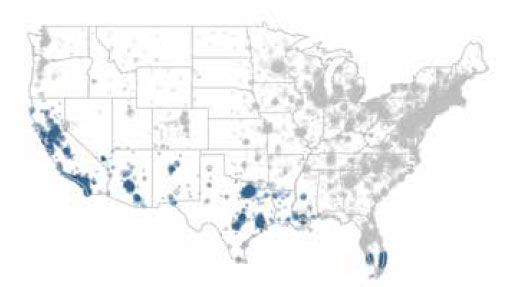
Les points bleus représentent l'E. canis dans les zones d’endémie.
Figure 2b. E. canis dans les zones d’endémie
Pour la maladie de Lyme et l’ehrlichiose, les patients exposés à des tiques infectées ont été définis comme ayant dans leurs antécédents disponibles au moins un résultat positif à un test de dépistage d’une maladie à vecteur. Les patients qui n’avaient pas été exposés à des tiques infectées étaient définis comme n’ayant que des résultats négatifs aux tests de dépistage des maladies à vecteur dans leurs antécédents disponibles. La MRC chronique bien établie était définie comme des augmentations concomitantes des taux de SDMA (> 14 μg/dL) et de créatinine (> 1,5 mg/dL) pendant au moins 25 jours accompagnées d’une densité urinaire inadéquate (< 1,030) durant la même période. De plus, les taux de SDMA et de créatinine ne devaient pas revenir aux valeurs normales dans les antécédents disponibles du patient. Une technique statistique appelée appariement selon les scores de propension a été utilisée pour contrôler les effets de l’âge, de la race et de la région sur l’exposition aux maladies à vecteur. Ainsi, chaque chien exposé à une maladie à vecteur a été apparié à quatre chiens non exposés présentant des facteurs de risque similaires. Au total, l’étude sur la maladie de Lyme a porté sur 322 145 chiens et celle sur E. canis a porté sur 22 440 chiens. Chaque étude visait à déterminer s’il existait un lien entre la maladie transmise par les tiques et la MRC. Les études n’étaient pas conçues pour établir une relation de cause à effet, mais plutôt pour indiquer une association statistiquement significative entre les deux affections.
Une des limites des études était le fait que les données ne précisaient pas les éléments suivants : (1) le moment de l’exposition aux tiques, (2) le moment où la maladie à vecteur a commencé à se manifester, (3) la présentation clinique, (4) le traitement, et (5) l’évolution du patient.
Résultats
La population canine pour les données sur la maladie de Lyme comprenait des chiens mâles et femelles âgés de 1 à 25 ans de toutes races (160 races nommées et « races autres » représentant 34,4 % de la population). Le risque relatif de MRC chez les patients exposés à des tiques porteuses de B. burgdorferi dans la région d’endémie établie de la maladie de Lyme était de 1,43 avec un intervalle de confiance (IC) à 95 % [1,27 à 1,61], p < 0,0001, ce qui signifie que ces chiens présentaient un risque plus élevé de 43 % de développer une MRC. La population canine pour les données sur Ehrlichia comprenait des chiens mâles et femelles âgés de 0 à 25 ans de toutes races (183 races nommées et « races autres » représentant 32,1 % de la population). Le risque relatif de MRC chez les patients exposés à des tiques porteuses d’Ehrlichia dans les zones d’endémie d’E. canis était de 2,12 avec un IC à 95 % [1,35 à 3,15], p = 0,0006, ce qui signifie que ces chiens avaient un risque plus élevé de 112 % de développer une MRC. Pour chaque comparaison effectuée, le seuil de signification statistique était une valeur de p < 0,05.
Discussion
Les chiens ayant des anticorps contre le peptide C6 de B. burgdorferi présentaient un risque plus élevé de 43 % de développer une MRC, tandis que les chiens porteurs d’anticorps anti-Ehrlichia dans les zones d’endémie d’E. canis présentaient un risque plus élevé de 112 % de développer une MRC. Ces deux résultats étaient statistiquement significatifs et cliniquement pertinents, ce qui indique qu’une surveillance régulière de ces patients séropositifs est médicalement nécessaire. Même si le protocole de ces études rétrospectives ne permettait pas de déterminer un lien de cause à effet, les résultats révèlent une association statistiquement significative entre les résultats positifs aux tests de dépistage de la maladie de Lyme ou de l’ehrlichiose dans les zones d’endémie et un risque accru de MRC. Il convient de noter que même si la présence d’E. canis est plus fréquente dans certaines régions géographiques des États-Unis, des chiens infectés par E. canis peuvent être trouvés partout au pays. En effet, E. canis a été identifié par test PCR (amplification en chaîne par polymérase) sur des échantillons soumis aux Laboratoires de référence IDEXX provenant de 42 des 50 États depuis 2011. Chez les patients exposés à des tiques infectées, la réalisation d’un bilan biochimique incluant le test IDEXX SDMA, qui permet de détecter un biomarqueur extrêmement sensible et spécifique de la fonction rénale, peut aider à mettre au jour une maladie rénale précoce pouvant être une complication d’une maladie à vecteur, comme la maladie de Lyme ou l’ehrlichiose.
Les chiens symptomatiques qui ont été exposés à des tiques infectées par B. burgdorferi ou Ehrlichia présentent un risque accru de maladie multisystémique3,7. Ces études confirment que les chiens qui obtiennent un résultat positif au test de dépistage de la maladie de Lyme ou de l’ehrlichiose dans les zones d’endémie courent un risque statistiquement plus élevé de développer une MRC. Par conséquent, une évaluation complète doit être envisagée chez ces patients, quel que soit leur âge. Outre le dépistage des maladies à vecteur, il serait indiqué d’effectuer chez ces patients un examen physique, une formule sanguine complète, un bilan biochimique avec le test IDEXX SDMA et une analyse d’urine avec examen du sédiment urinaire afin de déceler la présence d’une maladie multisystémique.
Comme les patients atteints d’une maladie à vecteur peuvent présenter d’autres problèmes systémiques ou une boiterie chronique entraînant une diminution de la masse musculaire, la concentration de créatinine peut ne plus être un bon indicateur de la fonction rénale. La découverte d’un taux élevé de SDMA chez un chien dont l’exposition à des tiques a été confirmée justifie l’élaboration immédiate d’un plan d’action pour diagnostiquer, prendre en charge et surveiller une éventuelle maladie rénale, en suivant l’algorithme de diagnostic du test IDEXX SDMA*. Le recours au dosage de la SDMA dans la démarche diagnostique aidera à déceler des changements rénaux qui pourraient autrement passer inaperçus, car la SDMA est un biomarqueur plus fiable que la créatinine. Chez les patients séropositifs pour B. burgdorferi, le test quantitatif de détection des anticorps (test Lyme Quant C6) est également recommandé.
Conclusion
En résumé, ces études ont révélé une association entre un résultat positif au dépistage de la maladie de Lyme ou de l’ehrlichiose et un risque accru de MRC chez les chiens dans les zones d’endémie. Les chiens qui avaient obtenu un résultat positif au test de dépistage de la maladie de Lyme par la détection d’anticorps ou un résultat positif au test de détection d’anticorps anti-Ehrlichia dans les zones où E. canis est endémique présentaient, respectivement, un risque plus élevé de 43 % et de 112 % de développer une MRC.
Chez les patients exposés à des tiques infectées, la réalisation d’un bilan biochimique incluant le test IDEXX SDMA peut aider à mettre au jour une maladie rénale précoce pouvant être une complication d’une maladie à vecteur, comme la maladie de Lyme ou l’ehrlichiose. Outre le dépistage des maladies à vecteur, il serait indiqué d’effectuer chez ces patients un examen physique, une formule sanguine complète, un bilan biochimique avec le test IDEXX SDMA et une analyse d’urine avec examen du sédiment urinaire afin de déceler la présence d’une maladie multisystémique.
Identifiez l’exposition avec le test SNAP 4Dx Plus
Le test pour usage clinique le plus fiable pour le dépistage des maladies vectorielles
Références
- Drake C, Ogeer JS, Beall MJ, et al. Investigation of the association between Lyme seroreactivity and chronic kidney disease in dogs [ACVIM Abstract ID08]. J Vet Intern Med. 2018;32(6):2264.
- Burton W, Drake C, Ogeer J, et al. Association Between Exposure to Ehrlichia spp. and Risk of Developing Chronic Kidney Disease in Dogs. J Am Anim Hosp Assoc. 2020; 56:159–164.
- Summers BA, Straubinger AF, Jacobson RH, Chang YF, Appel MJ, Straubinger RK. Histopathological studies of experimental Lyme disease in the dog. J Comp Pathol. 2005;133(1):1–13.
- Wagner B, Johnson J, Garcia-Tapia D, et al. Comparison of effectiveness of cefovecin, doxycycline, and amoxicillin for the treatment of experimentally induced early Lyme borreliosis in dogs. BMC Vet Res. 2015;11:163.
- Littman MP. Lyme nephritis. J Vet Emerg Crit Care. 2013;23(2):163–173.
- Harrus S, Waner T. Diagnosis of canine monocytotropic ehrlichiosis (Ehrlichia canis): an overview. Vet J. 2011;187(3):292–296.
- Little SE. Ehrlichiosis and anaplasmosis in dogs and cats. Vet Clin North Am Small Anim Pract. 2010;40(6):1121–1140.
*L'algorithme du test IDEXX SDMA est disponible à idexx.ca/fr/AlgorithmeSDMA
