Test antigénique Fecal Dx
Test antigénique Fecal Dx – pour diagnostiquer des infestations parasitaires que le microscope ne permet pas de détectés
Mise à jour diagnostique • Mars 2017
Introduction
Afin d’assurer la santé des patients, tout bilan de santé devrait comprendre des analyses fécales visant à détecter la présence de parasites intestinaux. Or, il peut être difficile de diagnostiquer avec précision l’infestation par certains parasites, notamment par les ankylostomes, les ascaris et les trichures, au moyen des méthodes actuelles. C’est pourquoi les Laboratoires de Référence IDEXX offrent désormais le test antigénique Fecal Dx™ comme outil additionnel pour le dépistage de ces parasites courants.
Vous désirez une copie de cette page?
Renseignements généraux
Les ankylostomes, les ascaris et les trichures sont des parasites intestinaux observés couramment en pratique des animaux de compagnie. Chacun de ces types de parasites est caractérisé par un cycle de vie unique et une période de prépatence (temps écoulé entre l’infestation de l’animal et la production d’œufs par le parasite) qui lui est propre : de 14 à 21 jours pour les ankylostomes, de 14 à 30 jours pour les ascaris, et jusqu’à 74 à 90 jours pour les trichures. La période prépatente peut faire en sorte que l’infestation passe inaperçue à l’examen microscopique, car les signes cliniques pourraient se manifester avant que des œufs soient présents dans les fèces.
Prévalence
Chez les chiens et les chats, la prévalence de l’infestation par les divers parasites intestinaux varie d’une région à l’autre et tend à être plus fréquente chez les animaux de refuge que chez les animaux de compagnie qui sont vus régulièrement par un médecin vétérinaire. Les animaux qui vont à l’extérieur et qui chassent des proies pouvant avoir des larves infectieuses dans leurs tissus sont aussi plus susceptibles d’avoir des parasites.
Des études ont montré que la prévalence des ankylostomes et des ascaris était respectivement de 2,5 % et de 2,2 % chez les chiens de compagnie1, comparativement à 20,2 % et à 15,2 % chez les chiens en refuge2. Une étude menée sur environ 1500 échantillons de fèces de chats a révélé que 7,5 % des chats étaient infestés par Toxocara cati3.
La prévalence des trichures chez les chiens aux États-Unis, d’après la détection d’œufs dans les fèces, varie de 1,2 % chez les chiens de compagnie1 à 14,3 % chez les chiens en refuge2. Les infestations par les trichures chez les chats sont rares en Amérique du Nord4.
Signes cliniques
De nombreux chiens et chats qui sont porteurs de parasites intestinaux peuvent être asymptomatiques, mais d’autres peuvent présenter un vaste éventail de signes gastro-intestinaux selon l’espèce parasitaire et l’âge de l’animal. Les symptômes peuvent varier de la diarrhée légère avec vomissements et perte de poids à une diarrhée hémorragique grave entraînant une anémie et parfois même la mort.
Méthodes diagnostiques actuelles
À l’heure actuelle, la méthode le plus fréquemment utilisée pour diagnostiquer les infestations par des parasites intestinaux est la flottation fécale, passive ou par centrifugation. Il existe de nombreux problèmes qui peuvent compliquer le diagnostic des infections avec cette méthode. Une complication possible est une erreur d'identification; le pollen et autre débris peuvent être identifiés comme étant des œufs. De plus, l'identification erronée des œufs provenant d'autres espèces résultant de la coprophagie (ingestion de fèces infectées) peut également se produire. Une étude a d’ailleurs révélé que 31,5 % des échantillons de fèces de chiens positifs pour Toxocara contenaient en fait des œufs de T. cati5.
De plus, la différence de densité des œufs des diverses espèces de parasites complique le choix de la solution optimale à utiliser pour s’assurer de recueillir les œufs de tous les parasites potentiels.
En outre, les méthodes fondées sur l’identification microscopique des œufs sont inefficaces lorsque l’animal n’excrète pas d’œufs, par exemple durant la période de prépatence ou en présence d’infestations par des vers du même sexe.
Enfin, la flottaison fécale n’est pas nécessairement toujours fiable en test unique. Comme beaucoup de parasites pondent des œufs de façon intermittente, il est possible d’obtenir un résultat faussement négatif si un seul échantillon de fèces est analysé.
Pour toutes ces raisons, il était nécessaire de trouver un meilleur outil pour le diagnostic des infestations par les parasites internes les plus courants chez les chiens et les chats.
Nouvelles options aux Laboratoires de référence IDEXX
De nos jours, les tests antigéniques sont couramment utilisés pour diagnostiquer l’infestation par le ver du cœur et Giardia, et un test antigénique est maintenant offert pour détecter les parasites intestinaux. Les Laboratoires de Référence IDEXX ont mis au point le test antigénique Fecal Dx faisant appel à la méthode immuno-enzymatique (ELISA) pour la détection des antigènes des ankylostomes, des ascaris et des trichures dans les fèces. Ces antigènes sont sécrétés par les vers adultes et ne sont pas présents dans les œufs; par conséquent, le test antigénique permet de déceler l’infestation pendant la période de prépatence et d’éviter les problèmes de diagnostic liés à la ponte intermittente. Le diagnostic établi tôt durant la période prépatente aura aussi pour conséquence de réduire la contamination de l’environnement par des œufs potentiellement infectieux. Comme le recommande le CAPC (Companion Animal Parasite Council), les tests antigéniques devraient être utilisés en association avec la coproscopie (examen microscopique des fèces pour la recherche de parasites) pour favoriser la détection la plus complète et précise possible des parasites chez les chiens et les chats6.
Détection d’un plus grand nombre d’infestations
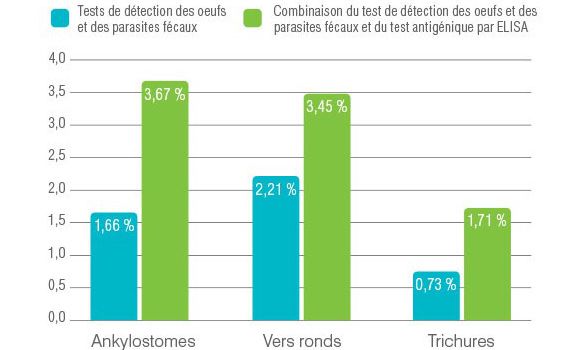
Plus de 750 000 résultats d’analyses fécales obtenus aux Laboratoires de Référence IDEXX sur des échantillons canins et félins, ont été analysés pour les résultats positifs pour les nématodes.
Les échantillons avaient été soumis pour être évalués à la fois par flottaison fécale par centrifugation (test OP) et par test antigénique ELISA pour la détection d’ankylostomes, ascaris et trichures.
Des œufs d’ankylostomes ont été détectés dans 1,7 % des échantillons fécaux et le test antigénique ELISA a été positif pour 2,0 % des échantillons négatifs au test OP, pour un total de 3,7 % en combinant les deux méthodes.
Des œufs d’ascaris ont été observés dans 2,2 % des échantillons fécaux et le test antigénique ELISA a été positif pour 1,3 % des échantillons négatifs au test OP, pour un total de 3,5 % en combinant les deux méthodes.
Des œufs de trichures ont été observés dans 0,7 % des échantillons de fèces canins et le test antigénique a été positif pour 1,0 % des échantillons négatifs au test OP, pour un total de 1,7 % en combinant les deux méthodes.
.
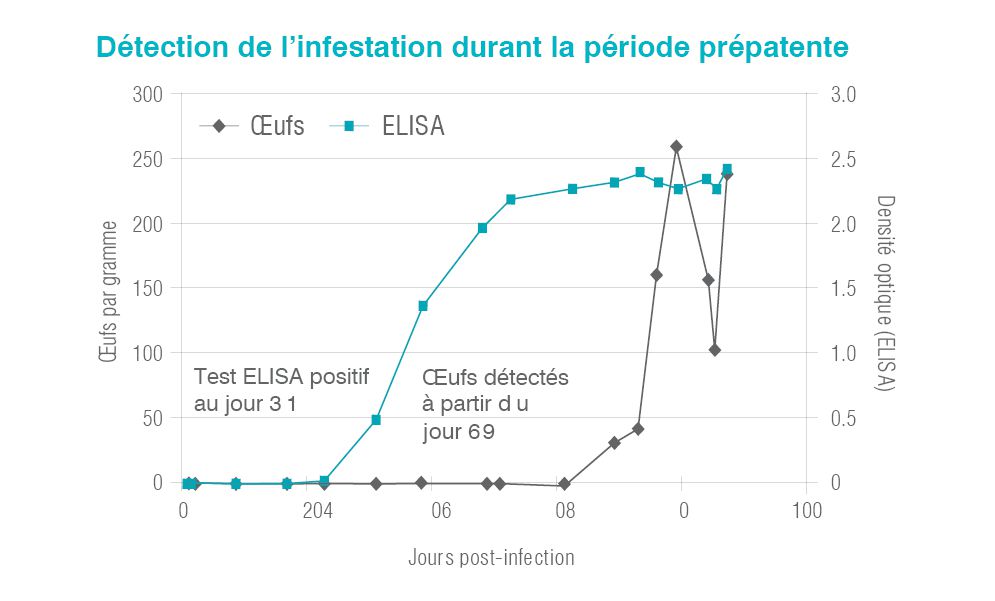
Détection plus précoce de l’infestation
En raison de l’impossibilité de détecter des œufs au microscope par le test fécal OP lors de la période de prépatence et lors d’infestations par des vers du même sexe, un grand nombre d’infestations échappe aux tests de dépistage pendant un certain temps, si bien qu’il est difficile d’établir une corrélation avec les signes cliniques. Dans le cadre d’une étude expérimentale, le test antigénique ELISA a permis de déceler l’infestation pendant la période de prépatence.
Le graphique ci-dessous illustre que le test antigénique ELISA a permis d’identifier les trichures environ 30 jours plus tôt que le test OP.
.
Traitement
Il existe tout un éventail d’anthelminthiques pour traiter et maîtriser les infestations par les ankylostomes, les ascaris et les trichures. Consultez les lignes directrices du CPAC (Companion Animal Parasite Council) pour obtenir des recommandations6.
Le test Fecal Dx* détecte les antigènes des parasites. Un résultat positif à ce test révèle une infestation. Il est possible d’obtenir un résultat positif au test antigénique et un résultat négatif au test OP durant la période de prépatence, lors d’infections par des parasites du même sexe, et en raison de l’excrétion intermittente des œufs. Le fait de voir des œufs à la coproscopie d’un échantillon qui a obtenu un résultat négatif au test antigénique pourrait s’expliquer par de la coprophagie ou un taux d’antigènes inférieur au seuil de détection. Un traitement doit être envisagé pour les patients qui obtiennent un résultat positif selon l’une ou l’autre des méthodes..
Considérations de santé publique et mesures préventives
En raison du potentiel zoonotique des parasites intestinaux, en particulier des ankylostomes et des ascaris, il est important d’éliminer immédiatement les selles. Cette habitude aura aussi pour effet de réduire le risque de réinfection et de contamination de l’environnement à long terme. Pour prévenir la poursuite du cycle, la prise mensuelle d’anthelminthiques peut être utile
.
Renseignements sur les tests
Code du test Nom et composition du test
Dépistage pour les chiens et chats en bonne santé :
FDXP Profil Antigène Fecal Dx (Flottaison)
Oeufs et parasites fécaux (flottaison), test antigènique pour les vers à crochets, vers ronds et trichures
Échantillon requis : 3–5 g de selles fraiches dans un contenant de plastique propre
Tests pour les chiens et chats malades :
FDXGP Profil Antigène Fecal Dx (Flottaison) avec Giardia
Oeufs et parasites fécaux (flottaison), test antigènique pour les Giardia, vers à crochets, vers ronds et trichures
Échantillon requis : 3–5 g de selles fraiches dans un contenant de plastique propre
FDXPCD Diarrhée Complet RealPCR avec Profil Antigène Fecal Dx (Flottaison)—Canin
Diarrhée Complet RealPCR, Bilan—Canin, oeufs et parasites fécaux (flottaison), test antigènique pour les vers à crochets, vers ronds et trichures
Échantillon requis : 5 g (1 g minimum) de selles fraîches dans un contenant stérile (garder réfrigéré) pour le bilan RealPCR et 3-5 g de selles fraîches dans un contenant de plastique propre pour le test oeufs et parasites et le test antigénique fécal. Prélever l’échantillon avant l’antibiothérapie.
FDXPFD Diarrhée Complet RealPCR avec Profil Antigène Fecal Dx (Flottaison)—Félin
Diarrhée Complet RealPCR, Bilan—Félin, oeufs et parasites fécaux (flottaison), test antigènique pour les vers à crochets, vers ronds et trichures
Échantillon requis : 5 g (1 g minimum) de selles fraîches dans un contenant stérile (garder réfrigéré) pour le bilan RealPCR et 3-5 g de selles fraîches dans un contenant de plastique propre pour le test oeufs et parasites et le test antigénique fécal. Prélever l’échantillon avant l’antibiothérapie.
Pour communiquer avec IDEXX
Service à la clientèle
Si vous avez des questions concernant les codes de tests, le délai d’exécution ou les prix, veuillez communiquer avec notre équipe du Service à la clientèle au 1 800 667-3411.
Des conseils d’experts à votre portée
Notre équipe de spécialistes en médecine interne est toujours disponible pour une consultation gratuite*. Si vous avez des questions, veuillez composer le 1 800 667-3411.
Lectures recommandées
Diagnostiquer les parasites intestinaux
Elsemore DA, Geng J, Flynn L, Cruthers L, Lucio-Forster A, Bowman DD. Enzyme-linked immunosorbent assay for coproantigen detection of Trichuris vulpis in dogs. J Vet Diagn Invest. 2014;26(3):404-411.
Elsemore DA, Geng J, Cote J, Hanna R, Lucio-Forster A, Bowman DD. Enzyme-linked immunosorbent assays for coproantigen detection of Ancylostoma caninum and Toxocara canis in dogs and Toxocara cati in cats.J Vet Diagn Invest. SAGE Journals website. Publié le 19 avrill 2017. Consulté le 16 juin 2017.
Mise à jour sur la recherche
Références
- Little SE, Johnson EM, Lewis D, et al. Prevalence of intestinal parasites in pet dogs in the United States. Vet Parasitol. 2009;166(1–2):144-152.
- Blagburn BL, Lindsay DS, Vaughan JL, et al. Prevalence of canine parasites based on faecal flotation. Compend Contin Educ Pract Vet.1996;18(5):483–509.
- Gates MC, Nolan TJ. Endoparasite prevalence and recurrence across different age groups of dogs and cats. Vet Parasitol. 2009;166(1–2):153-158.
- Bowman DD. Georgis’ Parasitology for Veterinarians. 9th ed. St Louis, MO: Saunders; 2009:224.
- Fahrion AS, Schnyder M, Wichert B, Deplazes P. Toxocara eggs shed by dogs and cats and their molecular and morphometric species-specific identification: is the finding of T. cati eggs shed by dogs of epidemiological relevance? Vet Parasitol. 2011;177(1–2):186-189.
- Companion Animal Parasite Council. Current advice on parasite control: intestinal parasites. www.capcvet.org/capc-recommendations. Consulté le 8 novembrer 2016.
L’information contenue aux présentes vise à fournir des renseignements généraux seulement. Comme dans le cas de tout diagnostic ou traitement,l’information clinique doit être utilisée à votre discrétion, en vous basant sur une évaluation complète du patient qui comprend l’anamnèse, l’examen physique et toutes les données de laboratoire. Comme dans le cas de tout traitement ou programme de suivi, vous devez vous référer aux feuillets d’information pour une description complète des doses, des indications,des interactions médicamenteuses et des précautions à prendre.